식품의약품안전처(식약처)와 한국보건의료연구원(보의연)이 신개발의료기기의 신속한 시장진입 지원체계 구축을 위해 식약처의 허가도우미와 보의연의 신의료기술평가를 시범 연계 운영한다.
식약처의 허가도우미는 2005년도부터 신개발의료기기 등의 제품 개발에서 허가에 이르는 과정에 필요한 기술적·행정적 지원을 맞춤형으로 실시하는 제도로 , 그동안 31개 제품이 허가를 받았다.
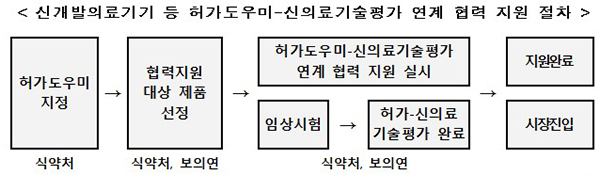
이번 지원사업은 27일부터 허가도우미로 지정된 3개 분야에 대해 시행하는데 ▲허가단계부터 신의료기술평가를 고려한 임상 설계 ▲개발제품 사용목적 구체화 ▲제조 및 품질관리시스템(GMP) 검토 ▲안전성 및 성능 검토 등 전주기 컨설팅을 실시할 계획이다.
특히 ‘임상시험 설계 자문’에서는 허가를 위한 임상시험 계획 설계단계에서 신의료기술평가를 동시에 고려할 수 있어 신의료기술평가시 안전성·유효성 연구결과의 미흡으로 시장진입이 어려워지는 것을 해소할 수 있을 것으로 예상된다.
식약처는 “그 동안 기술력은 있으나 영세한 업체는 전문인력이나 정보 부족으로 신의료기술 등재를 거쳐 시장 진입하는데 어려움을 겪었다”고 설명했는데, 실제로 기존기술을 제외하고 의료기기 허가 후 신의료기술 등재를 통한 시장진입 비율은 36.2%로 나타났다.
한편 식약처와 보의연은 이번 협력사업으로 신개발의료기기의 시장진입 기회가 확대될 것으로 전망하며, 원활히 운영될 수 있도록 노력할 것이라고 밝혔다.
<저작권자 ⓒ 미디어경제뉴스, 무단 전재 및 재배포 금지>
박진수 기자 다른기사보기




